เมื่อวันที่ 16 ส.ค. ศ.นพ.สุทธิพงศ์ วัชรสินธุ ผอ.รพ.จุฬาลงกรณ์มหาวิทยาลัย สภากาชาดไทย และคณบดีคณะแพทยศาสตร์ จุฬาฯ พร้อมด้วย นพ.นคร เปรมศรี ผอ.สถาบันวัคซีนแห่งชาติ ศ.นพ.เกียรติ รักษ์รุ่งธรรม ผอ.บริหารโครงการพัฒนาวัคซีนโควิด-19 ศูนย์วิจัยวัคซีน คณะแพทยศาสตร์ จุฬาฯ และรพ.จุฬาฯ สภากาชาดไทย ร่วมกันแถลงจ่าวความคืบหน้าการทดสอบวัคซีนป้องกันโควิด -19 “ChulaCOV-19” ชนิด mRNA ในอาสาสมัคร
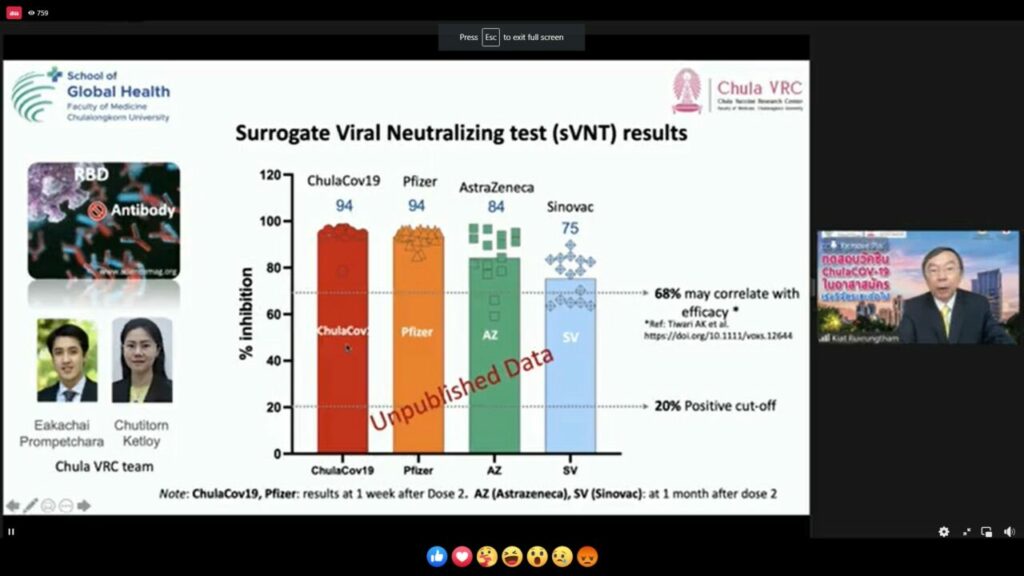
ศ.นพ.เกียรติ กล่าวว่า จากการทดทอบวัคซีนในคนระยะที่ 1 เริ่มเมื่อวันที่ 14 มิ.ย.ที่ผ่านมา โดยแบ่งอาสาสมัคร 72 คน เป็น 2 กลุ่ม กลุ่มแรกอายุ 18-55 ปี จำนวน 36 คน กลุ่มที่สอง อายุ 65-75 ปี จำนวน 36 คน ในจำนวนสองกลุ่มดังกล่าวจะแบ่งเป็นกลุ่มย่อยที่ฉีดวัคซีน 10 ไมโครกรัม, 25 ไมโครกรัม และ 50 ไมโครกรัม เพื่อดูว่าวัคซีนดังกล่าวมีประสิทธิภาพสูงสุดที่ปริมาณเท่าไร ผลเบื้องต้นการฉีดวัคซีนในกลุ่มอาสาสมัครอายุ 18-55 ปี 36 คน เข็ม 1 เข็ม 2 ห่างกัน 3 สัปดาห์พบว่าไม่มีผลข้างเคียงรุนแรง ผลข้างเคียงที่เกิดขึ้นอยู่ในขั้นเล็กน้อย ปานกลาง เช่น มีไข้ หนาวสั่น ปวดบริเวณที่ฉีด และดีขึ้นเฉลี่ย 1-3 วัน ทั้งนี้สามารถกระตุ้นภูมิคุ้มกันชนิดแอนติบอดีได้สูงเทียบได้กับวัคซีน mRNA เช่น ไฟเซอร์ได้ สามารถยับยั้งเชื้อสายพันธุ์ดั้งเดิมได้ดี ทั้งนี้เมื่อเจอกับเชื้อกลายพันธุ์ถึงแอนติบอดีลดลงแต่อยู่ในระดับสูงสามารถยับยั้งเชื้อกลายพันธุ์ได้ ทั้ง 4 สายพันธุ์ คือ อัลฟา เบตา แกมมา และเดลตา นอกจากนี้ยังสามารถกระตุ้นภูมิคุ้มกันชนิดที-เซลล์ ซึ่งจะช่วย ขจัดและสามารถควบคุมเชื้อที่อยู่ในเซลล์ของคนที่ติดเชื้อได้ แต่ต้องย้ำว่าการทดสอบนี้ยังจำนวนไม่มาก ส่วนกลุ่มอายุ 65-75 ปี ในปลาย ส.ค.นี้
ศ.นพ.เกียรติ กล่าวต่อว่า ในกลุ่มอายุ 18-55 ปี 36 คนที่เพิ่งออกมานี้จะมีการประชุมคณะทำงานเพื่อคัดเลือกสูตรวัคซีนที่เหมาะสม เพื่อทดสอบในระยะที่ 2 ต่อไป จำนวน 150-300 คน ขณะนี้คัดกรองอาสาสมัครเรียบร้อยแล้วคาดว่าหากเป็นไปตามแผน จะสามารถฉีดได้ประมาณวันที่ 25 ส.ค.นี้ ขณะเดียวกัน เนื่องจากปัจจุบันประชากรไทยมีการฉีดวัคซีนจะจำนวนมากแล้ว เชื่อว่าปี 2565 น่าจะมีการฉีดแล้วราวๆ 70-80% ซึ่งน่าจะมีความจำเป็นเรื่องการฉีดวัคซีนกระตุ้น ดังนั้นการพัฒนาวัคซีนเฟส 3 ของจุฬาฯ ก็จะคิดและจัดทำข้อมูลที่เพียงพอต่อการฉีดกระตุ้น และผู้ขึ้นทะเบียนวัคซีน เช่น สำนักงานคณะกรรมการอาหารและยาจะต้องพิจารณาเรื่องกติตาในการขึ้นทะเบียนวัคซีนเข็มกระตุ้นด้วย ทราบว่ามีการพิจารณากติกากันอยู่
อย่างไรก็ตามนอกจากการพัฒนาวัคซีนแล้ว เรายังมีความร่วมมือในการพัฒนาโรงงานผลิตวัคซีนในประเทศไทยคู่ขนานกันไปด้วย โดยโรงงานผลิตคือไทยฝรั่งเศส ไบโอเนท เอเชีย ที่จังหวัดพระนครศรีอยุธยา เป็นผู้รับถ่ายทอดเทคโนโลยี โดยเฉพาะเทคโนโลยีการเคลือบไขมัน ซึ่งการทำขนาดเล็กในแลปได้ผลดีอยู่ระหว่างการขยายสเกลใหญ่ขึ้น ทั้งนี้เพื่อให้ทุกขั้นตอนเป็นการผลิตและพัฒนาในประเทศไทย โดยคนไทยทั้งหมด ที่สำคัญตอนนี้เตรียมวัควีนรุ่น 2 ไว้ด้วย แม้ว่าผลการทดลองวัคซีนรุ่น 1 จะสามารถข้ามสายพันธุ์ได้ก็ตาม รวมถึงมีการเตรียมความพร้อมพัฒนาวัคซีนสำหรับเด็กด้วย

ศ.นพ.เกียรติ กล่าวต่อว่า วันนี้ต้องการให้คนไทยมาร่วมหาคำตอบ งดเสพสื่อทางลบ แต่มาหาทางออกร่วมกัน เพื่อให้วัคซีนที่พำลังพัฒนาในประเทศไทย 4 ตัวนั้น มีอย่างน้อย 1 ตัวสามารถอออกมาใช้ได้ภายในสงกรานต์ 2565 ซึ่งจะทำได้หรือไม่ จากการวิเคราะห์กับทีมพบว่ามีองค์ประกอบ 4 คือ 1.ประเทศไทยต้องไม่บริหารทุนแบบเดิม ต้องมีเป้าหมายร่วมกัน ทั้งรัฐ เอกชน ไม่ว่าจะเป็นงบประมาณ หรือเงินบริจาค โดยจะใช้ราวๆ 500-600 ล้านบาท 2.กติกาขึ้นทะเบียนวัคซีนของ อย. 3.โรงงานไทยต้องเร่งผลิตให้ได้จำนวนมากก่อนสิ้นปี 4. การจองวัคซีนของรัฐ-เอกชน ต้องชัดเจน ดังนั้นโดยสรุปเราต้องทำต่างจากเดิม

นพ.นคร กล่าวว่า นับเป็นข่าวดีในการร่วมมือในการพัฒนาวัคซีน mRNA เมื่อเราเดินทางมาถึงจุดนี้ เพราะการพัฒนาวัคซีนป้องกันโควิด -19 เป็นเรื่องท้าทาย ด้วยโรคระบาดรุนแรง ความท้าทายองค์ความรู้ เทคโนโลยี ที่การพัฒนาที่ต้องเร่งทำแข่งกับเวลา ซึ่งสถาบันวัคซีนมีการสนับสนุนงบประมาณการวิจัยในประเทศชัดเจน ทั้งการทดลองในสัตว์ ทุนซื้อวัคซีนในต่างประเทศมาพัฒนา ทุนในการพัฒนาโรงงาน และทุนการวิจัยในคนเมื่อเดือน มิ.ย. ที่ผ่านมา แต่ลำพังทุนสนับสนุนยังไม่เพียงพอ ต้องมีนักวิจัยที่เก่ง และมีการเลือกพัฒนาชนิดวัคซีนที่ดี แม้ทำช้ากว่าคนอื่น แต่ผลออกมาเทียบกับวัคซีนที่มีในขณะนี้ประสิทธิภาพก็ไม่ได้ด้อยกว่า อีกทั้งต้องขอบคุณอาสาสมัครมาร่วมกันพัฒนาวัคซีนโดยไม่หวังสิ่งตอบแทน เพื่อประโยชน์ต่อสาธารณะ

ทั้งนี้การทดสอบระยะต่อไป จะทำให้เราขยับเข้าใกล้ความเป็นจริงในการมีวัคซีนใช้เอง ยืนบนขาตัวเอง โดยทีมประเทศไทย ส่วน 4 ประเด็นที่เสนอมานั้นในส่วนที่เกี่ยวข้องกับสถาบันวัคซีนก็รับเป็นการบ้านไปดำเนินการต่อ นอกจากนี้ หากการพัฒนาวัคซีนชนิด mRNA สำเร็จ จะเป็นประโยชน์ในการต่อนอดเพื่อการควบคุมป้องกัน และรักษาโรคโควิด-19 โรคติดต่ออุบัติใหม่ในอนาคต รวมถึงโรคมะเร็งในอนาคนด้วย ส่วนการขึ้นทะเบียนมี อย.เป็นผู้พิจารณา ส่วนหนึ่งอาจจะมีการศึกษารูปแบบการขึ้นทะเบียนฉุกเฉิน เพื่อปรับแนวทางของประเทศ โดยยืนอยู่บนพื้นฐานความปลอดภัย และคุณภาพ โดยเฉพาะเรื่องความปลอดภัย เพราะต้องเอามาใช้กับคนจำนวนมาก กว่า 10 ล้านคน
อนึ่ง วัคซีน ChulaCov19 เป็นชนิด mRNA ผลิตโดยสร้างชิ้นส่วนขนาดจิ๋วจากสารพันธุกรรมของเชื้อไวรัสโคโรนา ซึ่งเมื่อร่างกายได้รับชิ้นส่วนของสารพันธุกรรมขนาดจิ๋วนี้เข้าไป จะทำการสร้างเป็นโปรตีนที่เป็นส่วนปุ่มหนามของไวรัสขึ้น (spike protein) และกระตุ้นให้เกิดการสร้างภูมิคุ้มกันไว้เตรียมต่อสู้กับไวรัสเมื่อไปสัมผัสเชื้อ เมื่อวัคซีนชนิด mRNA ทำหน้าที่ให้ร่างกายสร้างโปรตีนเรียบร้อยแล้ว ภายในไม่กี่วัน mRNA นี้จะถูกสลายไปโดยไม่มีการสะสมในร่างกายแต่อย่างใด ซึ่งจากการทดลองในลิงและหนูพบว่าช่วยยับยั้งไม่ให้เชื้อไวรัสเข้าสู่กระแสเลือดและสามารถสร้างภูมิคุ้มกันได้ในระดับสูง จึงนำมาสู่การผลิต และทดสอบทางคลินิกระยะที่ 1 ให้กับอาสาสมัครเมื่อวันที่ 14 มิ.ย.ที่ผ่านมา
สำหรับจุดเด่นของวัคซีน ChulaCov19 คือ 1. สามารถอยู่ในอุณหภูมิตู้เย็น 2-8 องศาเซลเซียส ได้นานถึง 3 เดือน และเก็บในอุณหภูมิห้อง 25 องศาเซลเซียส ได้นาน 2 สัปดาห์ ซึ่งทำให้การจัดเก็บรักษาง่ายกว่าวัคซีนโควิด-19 ชนิด mRNA ยี่ห้ออื่น 2.ผลการทดสอบในสัตว์ผ่านเกณฑ์ดีมาก โดยพบว่าฉีดในหนู 2 เข็ม ห่างกัน 3 สัปดาห์ แล้วให้หนูทดลองได้รับเชื้อโควิด-19 เข้าทางจมูก สามารถป้องกันหนูทดลองไม่ให้ป่วยเป็นโรค และยับยั้งไม่ให้เชื้อไวรัสเข้าสู่กระแสเลือด รวมทั้งสามารถลดจำนวนเชื้อในจมูกและในปอดลงไปอย่างน้อย 10,000,000 เท่า เมื่อทดสอบความเป็นพิษก็พบว่าปลอดภัยดี ส่วนหนูที่ไม่ได้รับวัคซีนจะเกิดอาการป่วยโควิด-19 ภายใน 3-5 วัน และทุกตัวมีเชื้อสูงในกระแสเลือด ในจมูก และปอด เป็นจำนวนมาก 3. วัคซีนชนิด mRNA สามารถผลิตได้เร็ว ไม่ต้องรอเพาะเลี้ยงเชื้ออย่างวัคซีนบางชนิด แต่วัคซีนชนิด mRNA เพียงรู้สายพันธุ์ของเชื้อก็ไปออกแบบวัคซีนได้ สังเคราะห์ในหลอดทดลอง ไม่เกิน 4 สัปดาห์ มีวัคซีนมาทดสอบในหนูได้ การที่ผลิตได้รวดเร็วนี้ ทำให้ไม่ต้องใช้โรงงานขนาดใหญ่ นอกจากนี้ เมื่อเกิดเชื้อกลายพันธุ์ก็สามารถสังเคราะห์วัคซีนได้เร็วเช่นกัน.